'짧은 선형 모티프'의 단백질 식별 메커니즘 규명
암 전이 단백질과 결합하는 분자 합성도 성공
미국 MIT 연구진, 저널 '이라이프'에 논문

(서울=연합뉴스) 한기천 기자 = 인간의 체내에 있는 단백질은 1개당 평균 약 400개의 아미노산으로 구성된다.
이들 아미노산은 길게 한 줄로 연결되면서 복잡한 3차원 구조로 접힌다. 단백질이 접힌 구조를 갖는 이유다.
어떤 단백질은 특별한 기능을 가진, 4개 내지 6개의 아미노산 연결 부위가 존재하는데 이를 '짧은 선형 모티프'(SLiM)라고 한다.
SLiM은 작고 단순한 구조지만 핵심적인 세포 과정인 단백질 간의 결합을 촉진한다.
지금까지 과학자들은 SLiM이 어떻게 결합할 파트너를 식별하는지 잘 몰랐다.
미국 매사추세츠 공대(MIT) 과학자들이 마침내 SLiM의 단백질 결합 메커니즘을 밝혀냈다.
SLiM이 어떻게 결합할 단백질을 선별하는지, 다시 말해 자신과 비슷한 구조를 가진 단백질을 어떻게 구별하는지 알아낸 것이다.
연구팀은 단백질체학 분석에 자체 개발한 검사 도구를 이용했다.
또 분석 과정에서 나온 정보를 활용해, 암의 전이에 관여하는 ENAH라는 단백질과 강하게 결합하는 분자를 합성하는 데도 성공했다.
MIT 생물학과의 에이미 키팅 생물공학 교수팀이 수행한 이 연구 결과는 두 편의 논문으로 작성돼 작년 12월 2일과 이달 25일(현지 시각) 저널 '이라이프(eLife)'에 실렸다.
논문의 수석저자인 키팅 교수는 "단백질이 결합 파트너를 선택할 때 어떤 방법을 쓰는지 알아냈다"라면서 "이를 단백질 디자인에 적용하면 연구나 치료 목적으로 단백질 기능을 조절할 수 있을 것"이라고 말했다.
인간의 유전체엔 대략 2만 개의 단백질을 합성하는 정보가 담겨 있다.
이들 단백질은 대부분 정해진 파트너 단백질(partner proteins)과 결합하며, 이렇게 매개되는 단백질 간 상호작용(PPI)은 40만 개가 넘을 거로 추정된다.
단백질 짝이 잘못 맞춰지거나 올바른 짝이라도 결합하는 위치나 시간이 맞지 않으면 암 같은 심각한 질병이 생길 수 있다.
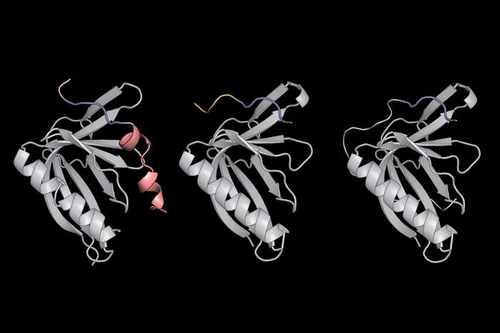
키팅 교수팀이 MassTitr라는 자체 검사 도구를 개발한 건 넓은 범주의 결합 친화력을 지닌 SLiM을 찾기 위해서다.
연구팀은 SLiM 핵심부의 양쪽 끝 아미노산이 단백질 결합에 중요한 역할을 할 거로 봤다.
인간 단백질체에서 36개 아미노산으로 구성된, 여유 있게 긴 부분을 MassTitr로 검사한 이유가 여기에 있다.
SLiM 핵심부의 어느 쪽에서 연장된 부분이 ENAH와 연관돼 있는지 확인하려는 것이었다.
ENAH는 세포의 이동을 돕는 단백질이다.
정상 세포에도 ENAH의 이런 능력이 중요하지만, 특히 암세포는 다른 조직에 전이하는 데 이를 이용한다.
연구팀은 ENAH의 발현을 줄이면 암세포가 다른 조직에 침윤하는 능력도 약해진다는 걸 확인했다.
연구팀은 MassTitr 덕에 SLiM을 갖추고 ENAH 단백질과 결합하는 단백질 33종을 발견했다.
SLiM 핵심부 염기의 측면에 위치해 SLiM과 ENAH의 결합을 훨씬 더 강하게 만드는, 3가지의 뚜렷한 아미노산 패턴도 찾아냈다.
이 중 하나는 가장 높은 친연성을 갖고 ENAH와 결합한 PCARE라는 단백질에서 발견됐다.
X선 결정학 기술과 컴퓨터 프로그램으로 분석한 결과, PCARE의 SliM 측면에 위치한 아미노산이 PCARE의 형태 변화를 유도하는 것으로 나타났다. 그러면 양쪽의 결합 사이트가 강하게 붙었다.
ENAH와 거의 같은 '자매 단백질' 2종(VASP, EVL)은 이런 구조 변화가 생기지 않아 PCARE SliM과 세게 결합하지 못했다.
연구팀은 ENAH와 결합하는 단백질을 디자인할 때 PCARE와 ENAH의 독특한 상호작용에서 영감을 받았다.
논문 저자로 참여한 테레사 황 박사는 "질병을 유발하는 단백질 간 상호작용을 합성 분자로 교란할 수 있는 기초가 마련됐다"라고 말했다.
cheon@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>




