식품의약품안전처는 국내 개발 신종 코로나바이러스 감염증(코로나19) 백신 `NBP2001`의 임상 1상 시험계획과 치료제 `DW2008S` 임상 2상 시험계획을 각각 승인했다고 23일 전했다.
이로써 현재 국내 코로나19 관련 임상시험 승인은 총 30건이고, 이 중 22건(치료제 19건, 백신 3건)이 진행 중이다.
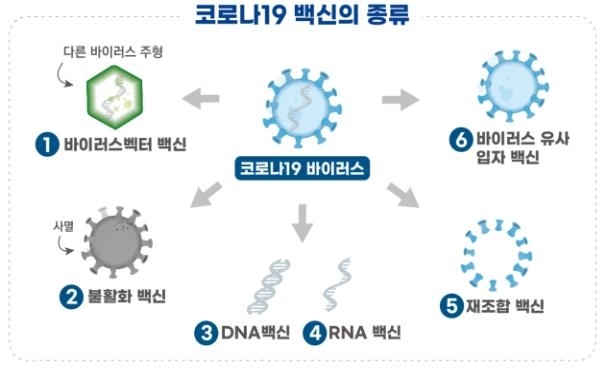
이날 연합뉴스 보도에 따르면 SK바이오사이언스의 NBP2001 임상 1상은 건강한 성인을 대상으로 안전성과 면역원성을 평가한다.
해당 백신은 코로나19 바이러스의 표면항원 단백질을 유전자조합기술로 제조한 `재조합 백신`이다.
백신의 표면항원 단백질이 면역세포를 자극해 면역 반응을 유도하며, 코로나19 바이러스가 침입하는 경우 항체가 바이러스를 제거한다.
이에 앞서 임상시험을 승인한 2건의 백신은 `DNA 백신`으로, 코로나19 바이러스의 표면항원 단백질 유전자를 주입해 면역반응을 유도하는 원리였다.
동화약품[000020]의 `DW2008S` 임상 2상은 중등증 코로나19 환자를 대상으로 유효성과 안전성을 평가한다.
이 의약품은 천식치료제 신약으로 개발 중인 천연물 의약품이다. 천식치료제 개발 당시 건강한 사람을 대상으로 한 임상에서 안전성과 내약성을 평가했다.




