베타세포 표면 '죽음의 수용체', 특정 단백질과 결합해 자멸사 유도
손쓰지 못하는 1형 당뇨병, 근원 치료법 개발될 수도
미국 하버드의대 연구진, 저널 '네이처 커뮤니케이션'에 논문
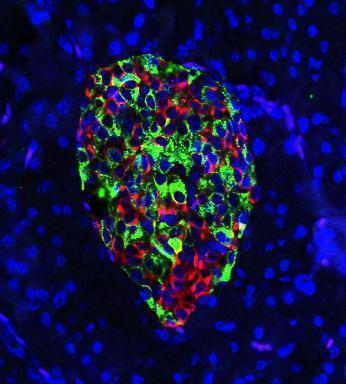
(서울=연합뉴스) 한기천 기자 = 어린이한테 많이 생기는 1형 당뇨병은 췌장의 베타세포가 사멸해 인슐린이 잘 생성되지 않는 대사질환이다.
지금까지 1형 당뇨병은 일종의 자가면역(autoimmune) 질환으로 여겨졌다. 면역계의 이상 반응으로 베타세포가 죽는다고 본 것이다.
2형 당뇨병도 베타세포가 파괴되기는 마찬가지다.
하지만 2형 당뇨병에선 신체 조직의 인슐린 내성이 문제를 일으킨다. 베타세포가 쉬지 않고 인슐린을 만들다가 탈진해 죽는 것이다.
그런데 1형 당뇨병에서 베타세포가 죽게 만드는 세로 경로(cellular pathway)가 따로 있다는 연구 결과가 나왔다.
이 경로를 차단하면 베타세포가 손상되지 않고 인슐린 생성도 증가한다는 게 동물 실험과 인간의 췌장 세포 실험에서 확인됐다.
이 발견은 1형 당뇨병에 효과적인 치료법 개발로 이어질 수 있다고 과학자들은 말한다.
전체 당뇨병 환자의 약 10%를 점유하는 1형 당뇨병은 현재 근원적인 치료법이 없다. 환자는 계속 인슐린을 투여해야 생명을 유지할 수 있다.
미국 보스턴 아동병원(Boston Children's Hospital)의 파올로 피오리나 박사팀이 주도적으로 수행한 이 연구 결과는 지난 3일(현지 시각) 저널 '네이처 커뮤니케이션'(Nature Communications)에 논문으로 실렸다.
피오리나 박사는 하버드 의대의 소아청소년과 부교수다.
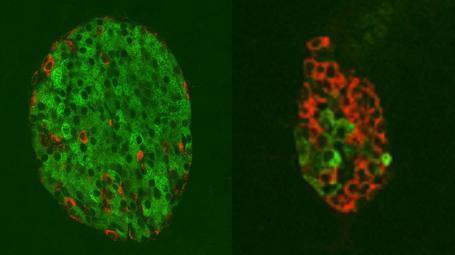
피오리나 교수팀은 베타세포 표면에서 TMEM219이라는 수용체를 찾아내 '죽음의 수용체'라는 이름을 붙였다.
베타세포의 사멸을 유도하는 세포 경로는 이 수용체와 IGFBP3(인슐린 유사 성장인자 결합 단백질 3)의 상호작용으로 작동했다.
TMEM219 수용체와 IGFBP3 단백질이 결합하면 베타세포는 '세포자멸사'(apoptosis)로 내몰렸다. '세포자살'이라고도 하는 세포자멸사는 다세포 생물에서 관찰되는 '세포예정사'(Programmed cell death)의 한 형태다.
세포자멸사는 원래 생명체에 나쁜 것이 아니며 생명주기 등에 유익하게 작용한다.
문제는 세포자멸사 기제가 엉뚱한 데서 비정상적으로 작동하는 것이다.
피오리나 교수는 이 세포 경로에 대해 "베타세포 수를 통제하는 자연 메커니즘일 수 있다"라면서 "하지만 당뇨병에 걸리면 IGFBP3 단백질의 생성이 늘어나 베타세포가 죽는 것 같다"라고 말했다.
연구팀은 당뇨병 환자의 혈중 IGFBP3 수치가, 당뇨병이 없는 사람보다 훨씬 높다는 걸 확인했다.
당뇨병 위험 요인을 가진 사람도 이 단백질 수치가 높았다.
생쥐 실험에서도 비슷한 결과가 나왔다.
실제로 당뇨병 증상이 있거나 위험 요인을 가진 경우에 IGFBP3 단백질 수치가 높게 나왔다.
그러나 이 세포 경로를 차단한 생쥐는 베타세포가 죽지 않았고 인슐린 생성도 늘어났다. 이런 생쥐는 당뇨병이 아예 생기지 않거나 발생이 늦춰졌다.
이 세포 경로를 장기간 막으면 전체 베타세포 수가 늘어난다는 것도 확인했다.
인간의 베타세포도 IGFBP3에 노출되면 자멸사 비율이 커졌고, 세포 경로를 차단하면 계속해서 인슐린을 생성했다.
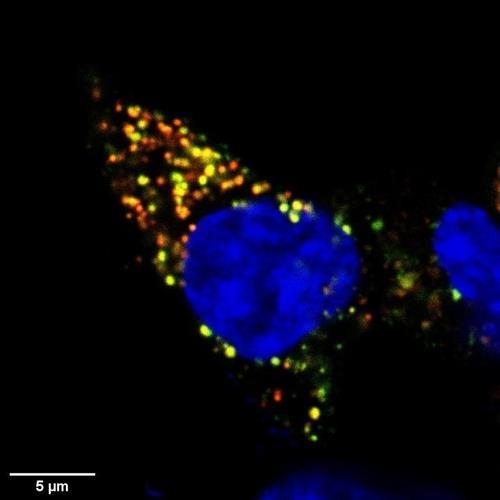
피오리나 교수는 "흔히 1형 당뇨병이 자가면역 질환이라고 생각하는데 면역치료를 해도 완전히 치료되지 않는다"라면서 "베타세포의 항상성 조절 장애가 관여하는 것 같고, 여기서 IGFBP3 단백질은 (이런 장애를 일으키는) 독소 역할을 하는 것으로 보인다"라고 설명했다.
한편 피오리나 교수는 자신이 설립한 생명공학 회사에서 IGFBP3/TMEM219 세포 경로를 차단하는 항체치료제를 개발 중이다.
이르면 올해 9월께 사람을 대상으로 하는 첫 임상 시험을 유럽에서 시작할 것으로 예상한다.
cheon@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>


