GIST 엄수현 교수 "전이억제 항암제·퇴행성 신경질환 치료 기여"
(대전=연합뉴스) 이주영 기자 = 국내 연구진이 우리 몸을 구성하는 세포의 모양을 유지하거나 운동, 세포분열 등 생존에 관여하는 새로운 세포 골격 조절 단백질(EFhd2)의 구조와 작용 메커니즘을 밝혀냈다.
광주과학기술원(GIST) 생명과학부 엄수현 교수팀은 15일 세포 골격과 상호작용하며 세포 모양 유지, 이동, 세포분열 등 생존에 필수적인 현상을 조절하는 신규 세포 골격 단백질인 'EFhd2'의 고해상도 3차원 구조와 작용 메커니즘을 처음으로 규명했다고 밝혔다.
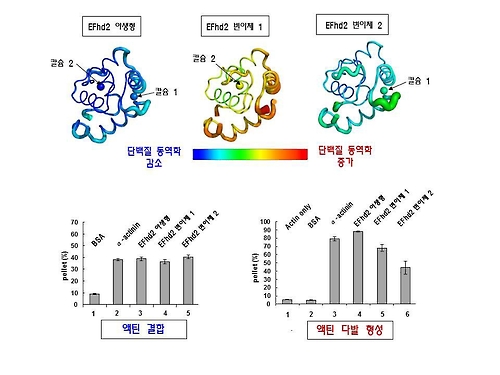
EFhd2는 세포 가장자리의 운동성 돌기 부분에 집중적으로 발현, 세포 이동과 분열에 필수 요소인 세포 골격 단백질 '액틴'에 결합하는 단백질이다.
이 단백질이 과도하게 발현되면 세포 이동속도가 증가하고 이로 인해 암세포 전이에 영향을 미치며 알츠하이머 환자에서는 발병 원인 물질인 타우(τ) 변이체와 함께 응집돼 병을 일으키는 것으로 알려졌으나 이 단백질의 3차원 구조와 작용 메커니즘은 지금까지 밝혀지지 않았다.
연구진은 이 연구에서 X-선 결정학 기법으로 EFhd2에 칼슘이 결합한 구조와 결합하지 않은 3차원 구조를 밝혀냈다.
이들은 EFhd2의 액틴 결합부위에 있는 칼슘결합 필수 구조(EF-hand 도메인)에 칼슘이 결합하면 액틴 결합부위의 구조가 안정화돼 액틴 다발형성 유도가 가능해지고, 이 구조에 칼슘이 결합하지 않으면 액틴 결합부위가 역동적인 구조로 변화되는 것을 확인했다.
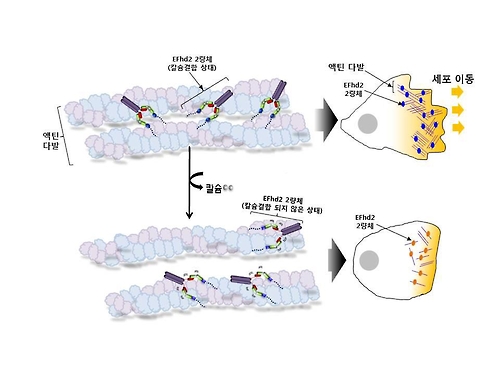
연구진은 이런 구조적 변화가 칼슘이 결합하지 않은 EFhd2의 액틴 다발형성 기능 감소 원인이라며 이는 EFhd2에 의한 세포 골격 조절기능이 칼슘결합 여부에 따라 발생하는 구조적 역동성 변화에 기인한다는 것을 의미한다고 설명했다.
엄 교수는 "이 연구는 세포 생존 조절에 관여하는 EFhd2의 칼슘결합 여부에 따른 액틴 다발형성 조절 메커니즘을 처음으로 밝힌 것"이라며 "암세포 전이억제를 위한 항암제 개발이나 알츠하이머병·치매 등 신경퇴행성 질환 치료제 개발에 기여할 것으로 기대한다"고 말했다.
한국연구재단 기초연구사업 등의 지원으로 수행된 이 연구 결과는 국제학술지 '사이언티픽 리포트'(Scientific Reports, 12월 15일자)에 게재됐다.

scitech@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>


