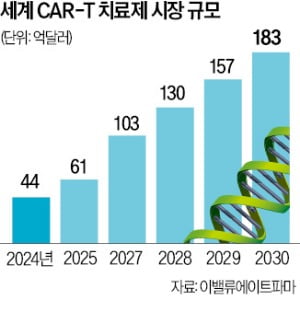
 6일 업계에 따르면 큐로셀은 지난 8월 CAR-T 치료제 후보물질 ‘안발셀’의 승인 심사를 식품의약품안전처에 신청했다. 신속 승인 절차를 밟고 있어 내년 초에는 심사 결과가 나올 것이라는 게 업계 관측이다. 안발셀은 면역세포 중 하나인 B세포가 암이 된 거대B세포림프종(LBCL) 치료제다. 회사 관계자는 “안발셀이 킴리아보다 효능이 뛰어나다는 게 임상에서 입증됐다”며 “식약처가 이런 점을 고려해 신속 승인 대상으로 지정했다”고 설명했다.
6일 업계에 따르면 큐로셀은 지난 8월 CAR-T 치료제 후보물질 ‘안발셀’의 승인 심사를 식품의약품안전처에 신청했다. 신속 승인 절차를 밟고 있어 내년 초에는 심사 결과가 나올 것이라는 게 업계 관측이다. 안발셀은 면역세포 중 하나인 B세포가 암이 된 거대B세포림프종(LBCL) 치료제다. 회사 관계자는 “안발셀이 킴리아보다 효능이 뛰어나다는 게 임상에서 입증됐다”며 “식약처가 이런 점을 고려해 신속 승인 대상으로 지정했다”고 설명했다.임상 2상에서 안발셀은 객관적반응률(ORR) 75.3%, 완전관해(CR) 67.1%를 보였다. 객관적반응률이란 암세포가 일정 기준 이상 줄어든 환자 비율을 의미하며 완전관해는 암세포가 완전히 사라져 관찰되지 않는 것을 뜻한다. 국내 유일의 CAR-T 치료제인 킴리아는 확증임상에서 ORR 52%, CR 40%를 나타냈다. 큐로셀 관계자는 “효능뿐 아니라 안전성 면에서도 안발셀이 더 우수한 결과를 보였다”고 덧붙였다.
안발셀은 효능뿐 아니라 가격 경쟁력, 치료 소요 기간 측면에서도 킴리아를 앞설 것으로 기대된다. CAR-T 치료제는 환자 피에서 채취한 면역세포(T세포) 유전자를 조작해 맞춤 배양하는 절차를 거치는데, 킴리아는 미국 공장에서 이 과정이 이뤄진다. 치료제 제조와 투약까지 1~2개월이 소요되는 이유다. 반면 안발셀은 국내에서 제조되기 때문에 이 기간이 절반 이상 짧다. 시간을 다투는 혈액암 환자 치료에 국산 제품이 더 경쟁력을 갖출 것이라는 분석이 나오는 배경이다.
큐로셀은 안발셀의 급여 등재 준비도 서두르고 있다. 회사 관계자는 “보건복지부의 허가-평가-협상 병행 시범사업에 신청서를 제출했다”며 “선정되면 허가부터 급여 평가, 약가 협상까지 연계해 진행할 수 있을 것”이라고 말했다.
앱클론은 임상 2상 환자 등록이 막바지에 이르렀다. 중간 결과가 이르면 연말에 나올 것으로 보인다. 티카로스는 임상 1상 환자 투약을 시작했다. 지씨셀과 HK이노엔, 박셀바이오 등은 고형암 치료 목적의 CAR-T 치료제를 개발하고 있다.
이우상 기자 idol@hankyung.com

