日, 임상 1단계 거치면 허가…건강보험도 적용 '파격'
中, 줄기세포 규제 없고 연구개발비 대폭 늘려
韓, 컨트롤타워 사라지고 각종 규제까지 '이중고'
[ 김형호 기자 ] 일본과 중국이 한국에 뒤진 줄기세포 치료제 상용화 분야에서 대대적인 반격에 나섰다. 일본은 2년여의 준비기간을 거쳐 관련법까지 개정하며 줄기세포 치료제 개발을 독려하고 있고, 줄기세포 연구에 대한 규제가 거의 없는 중국은 정부 주도형 연구개발(R&D) 투자를 늘리고 있다.
○한국 추격 나선 일본
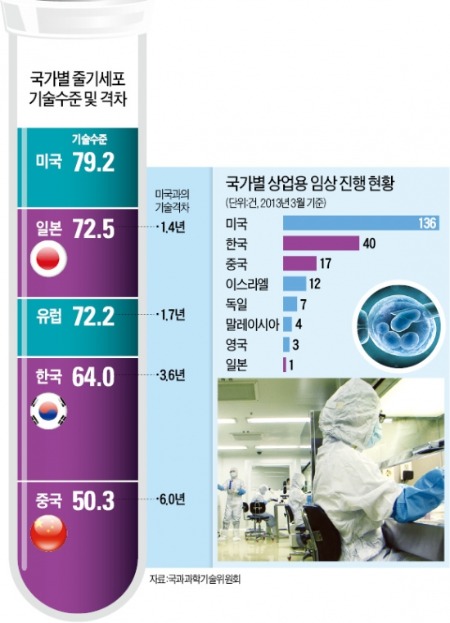
일본은 야마나카 신야 교토대 교수가 2012년 ‘유도만능줄기세포 연구’로 노벨상을 받은 뒤 줄기세포 치료제 개발에 눈을 돌렸다. 일본은 줄기세포 기술력에서는 미국에 이어 2위권이지만 치료제를 상용화하는 데 필요한 임상개발은 미국(136건) 한국(40건)은 물론 중국(17건)에도 한참 뒤진 1건(작년 3월 기준)에 불과하다.
일본 정부는 상업용 줄기세포 치료제 개발을 독려하기 위해 ‘줄기세포 치료제에 건강보험을 적용하고, 안전성만 확인되면 조기에 판매허가를 내준다’는 쪽으로 약사법을 지난달 개정했다. 의약품의 안전성을 검증하는 ‘임상 1상’ 시험단계를 통과하면 치료제로 허용하고 보험 혜택도 주겠다는 것이다. 임상 3상(약효의 유효성까지 입증)을 마쳐야 하는 한국과 비교하면 매우 파격적인 조치다.
한국에서는 지금까지 4개 품목의 줄기세포 치료제가 판매 허가까지 받았지만 건강보험 적용은 받지 못하고 있다. 한국에서 처음 줄기세포 치료제 허가를 받은 파미셀의 김현수 사장은 “줄기세포 치료제 개발에 소홀했다고 판단한 일본 정부가 단기간에 만회하기 위해 국책연구기관인 미쓰비시리서치를 통해 2년 전부터 한국 바이오업체를 분석하고 자문하는 등의 준비를 해왔다”고 설명했다.
○줄기세포 시험장 중국
중국은 국가식품약품감독관리국(CFDA)이 지난해 ‘줄기세포 치료제 임상시험 가이드라인’을 내놨다. 인허가 규정은 아직 없다. 규제가 없기 때문에 다양한 연구개발이 가능하다. 메디포스트 파미셀 등 한국 줄기세포 관련업체들이 중국에 진출하는 것도 상대적으로 쉬운 개발 환경 때문이다.
국가 차원에서는 2010년 10억위안(약 1500억원)이던 줄기세포 연구개발비 예산지원액을 2013년 15억위안(약 2300억원)으로 늘렸다. 줄기세포 치료제를 상업화하기 위한 임상 건수는 한국보다 적지만, 개별 임상시험당 참여자 숫자는 한국의 1.5배에 달한다. 막대한 인적 자원 덕분에 다양한 경로로 질이 좋은 줄기세포 확보가 가능한 것도 중국의 경쟁력이다.
○컨트롤타워도 없는 한국
이명박 정부에서는 국가과학기술위원회가 각 부처에 흩어져 있는 줄기세포 치료제 연구개발을 일원화하는 방안을 검토하는 등 컨트롤타워 역할을 했다.
국과위는 2012년 11월 ‘줄기세표 연구개발 투자효율화 방안’ 관계부처 합동회의에서 “영국이 줄기세포 주도권 10년 계획을 수립하고 중국 등 신흥국이 역동적으로 투자 확대에 나서는 상황에 미온적으로 대응하면 ‘넛크래커’(호두 까는 기계)에 낀 신세가 될 가능성이 크다”며 “각 부에서 개별적으로 추진하는 사업을 종합 조정할 필요가 있다”고 지적하기도 했다.
하지만 박근혜 정부가 들어선 뒤 국과위가 없어지면서 컨트롤타워 기능이 사라졌다. 줄기세포를 연구하는 한 업체 관계자는 “줄기세포 치료제는 다른 화학의약품에 비해 한국이 충분히 경쟁력을 가질 수 있는 분야인데도 정부는 규제 일변도로만 접근하고 있다”며 “미래 먹거리로 육성하기 위한 종합대책이 절실하다”고 말했다.
김형호 기자 chsan@hankyung.com
[한경+ 구독신청] [기사구매] [모바일앱] ⓒ '성공을 부르는 습관' 한국경제신문, 무단 전재 및 재배포 금지 �



