입원·사망률 감소 30%…선천적 결손증 등 부작용 적시 판매
성장 영향 우려 18세이하 사용금지…치료에 제한적 역할 머물듯

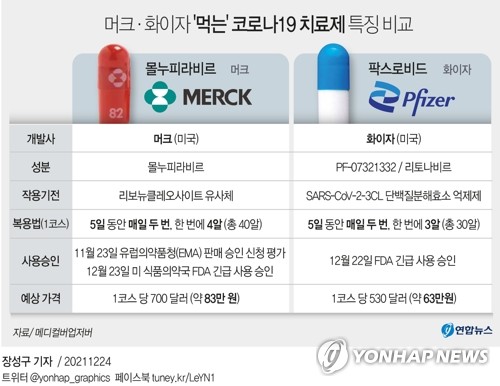
(워싱턴=연합뉴스) 김경희 특파원 = 미국 식품의약국(FDA)이 23일(현지시간) 제약사 머크앤드컴퍼니(MSD)가 개발한 신종 코로나바이러스 감염증(코로나19) 알약 치료제 '몰누피라비르' 사용을 승인했다.
앞서 FDA는 전날 화이자의 코로나19 알약 치료제 '팍스로비드' 사용을 승인한 바 있다.
AP와 로이터 등 외신은 하루 차로 첫 승인을 받은 화이자의 치료제가 약효가 뛰어나고 부작용이 적은 것으로 확인됐다며, 상대적으로 MSD 치료제의 비중이 줄어들 전망이라고 보도했다.
MSD 치료제는 몇 주 전까지도 코로나19 팬데믹(대유행)을 종식할 획기적 대안으로 큰 주목을 받아왔지만, 애초 발표보다 실제 효과가 미치지 못하는 데다 심각한 부작용 가능성이 있어 제한적 역할에 머물 수도 있다.
몰누피라비르가 고위험군 감염자의 입원 및 사망률을 낮추는 비율은 약 30% 정도로, 90% 가까이인 화이자 치료제에 비해 크게 낮다.
영국은 지난 11월초 MSD 치료제 사용을 승인한 바 있다.
FDA는 노령층과 비만 및 심장 질환자 등 고위험군을 포함해 입원 가능성이 높은 경증 코로나19 환자를 대상으로, 다른 치료제 대안이 없거나 의학적으로 적합한 경우에 대한 몰누피라비르 사용을 허가했다.
18세 이하 환자의 경우 성장에 영향을 미칠 수 있다는 이유로 사용이 금지됐다.
약품은 선천적 결손증(birth defects)을 포함한 심각한 안전 문제에 대한 경고를 부착한 상태로 판매될 예정이다.
가임기 여성은 약 복용 기간 및 이후 몇일간 피임 상태를 유지해야 하고, 남성의 경우 최종 복용 이후 3달간은 피임해야 한다고 FDA는 제한했다.
화이자 치료제의 경우 이 같은 부작용은 발견되지 않았다.
미국 정부는 앞서 한 치료 분량당 700달러의 가격으로 몰누피라비르 500만 회분 구매 계약을 맺은 상태다.
kyunghee@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>

