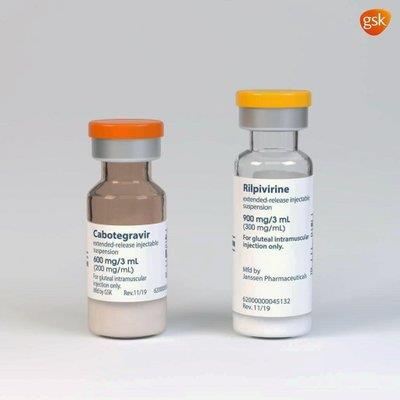
(서울=연합뉴스) 한성간 기자 = 미국 식품의약국(FDA)은 최초로 한 달에 한 번만 맞으면 되는 에이즈(후천성 면역결핍증) 치료 주사제 카베누바(Cabenuva)를 승인했다.
케베누바의 승인으로 에이즈 환자는 매일 여러 개의 알약을 식사를 전후해 여러 차례 경구 투여해야 하는 번거로움에서 벗어날 수 있게 됐다고 AP통신이 23일 전했다.
카베누바는 존슨 앤드 존슨 제약회사의 기존 치료제 릴피비린(제품명: 에두란트)에 비브 헬스케어(ViiV Healthcare)가 개발한 신약 카보테그라비르를 병용하는 것으로 한 달에 한 번 예정된 시간에 따로따로 근육 주사로 투여한다.
카베누바는 서서히 오랜 시간에 걸쳐 방출되는 서방형(ER: extended-release) 주사제다.
카베누바는 에이즈를 일으키는 인간 면역결핍 바이러스(HIV: human immunodeficiency virus)가 기존의 경구 치료제로 잘 억제되는 성인 에이즈 환자들을 위해 승인된 것이라고 FDA는 설명했다.
또 새로 승인된 두 주사제에 대한 바이러스의 저항이 나타나지 않는 환자라야 한다고 FDA는 강조했다.
그래서 FDA는 경구용 카보테그라비르도 승인, 카베누바로 전환하기 전에 릴피바린과 함께 한 달 동안 경구 복용하면서 내약성이 괜찮은지를 확인할 수 있도록 했다.
카베누바는 에이즈 환자 1천182명을 대상으로 무작위 대조군 설정(randomized controlled) 방식과 실험군과 대조군을 공개하는 공개형(open-label) 방식의 임상시험에서 HIV 억제가 유지되고 기본 CD4+ 세포 수에 변화가 없는 것으로 나타났다.
카베누바의 부작용은 피로감, 두통, 근육통, 오심, 수면장애, 현기증, 발진 등이다.
카베누바의 가격은 첫 회분은 고용량으로 5천940달러, 그다음 달부터는 3천960달러가 될 것이라고 비브 헬스케어 사는 밝혔다.
샌프란시스코 캘리포니아대학의 HIV 전문의 스티븐 딕스 박사는 카베누바가 에이즈 환자들의 삶의 질을 개선해 줄 것이라고 논평했다.
매일 경구 치료제를 복용하면서 자신이 에이즈 환자라는 사실을 떠올리는 것이 싫을 것이라고 그는 지적했다.
비브 헬스케어 사는 카보테그라비르를 에이즈 예방약으로도 승인을 신청할 계획이다.
최근 두 차례의 임상시험에서 카보테그라비르를 두 달에 한 번 주사하는 것이 또 다른 에이즈 치료제이자 예방약인 트루바다(Truvada)를 매일 경구 복용하는 것보다 HIV에 감염된 섹스 상대자로부터 바이러스를 비감염자에게 옮기는 것을 차단하는 효과가 큰 것으로 나타났다.
skhan@yna.co.kr
(끝)
<저작권자(c) 연합뉴스, 무단 전재-재배포 금지>


