TDM은 약물 투여 후 이 약물이 치료적인 범위 내에 있는지 또는 약물 투여 후 몸 속 면역반응이 발생했는지 여부를 확인하는 검사다.
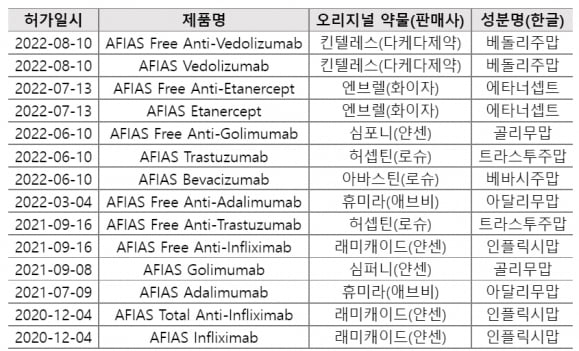
이번에 승인받은 진단키트는 ‘AFIAS Vedolizumab’ ‘AFIAS Free Anti-Vedolizumab’ ‘AFIAS Etanercept’ ‘AFIAS Free Anti-Etanercept’ 등 4종이다.
AFIAS Vedolizumab은 중증의 활성 궤양성 대장염이나 크론병 치료를 받는 환자에게 투여되는 ‘베돌리주맙’(제품명 킨텔레스)의 혈중 농도를 측정하는 진단키트다. AFIAS Free Anti-Vedolizumab은 베돌리주맙 투약 후 면역반응에 의한 항체의 생성 여부를 측정한다.
AFIAS Etanercept는 류머티즘 관절염, 건선성 관절염, 축성 척추관절염, 건선 환자에게 투여되는 ‘에타너셉트’(제품명 엔브렐)의 혈중 약물농도를 측정한다. 에타너셉트 투여 후 면역반응에 의한 항체의 생성여부를 측정하는 진단키트가 AFIAS Free Anti- Etanercept다.
바디텍메드는 혈중 약물의 농도와 면역반응 확인을 위한 검사에 소요되는 시간을 3주에서 12분으로 줄인 TDM 제품을 개발해 공급하고 있다. 임상적 성능은 기존 방식과 유사한 수준을 유지하면서 시간은 단축해 환자 편의성을 높였다는 설명이다.
최의열 바디텍메드 대표는 “이번 수출허가 추가 승인으로 TDM 사업에 속도가 붙고 있다”며 “환자 편의성과 제품의 정확성 등을 강조한 마케팅과 추가 공급사 확보에 총력을 다해, 글로벌 TDM 시장을 선도하는 기업으로 도약하겠다”고 말했다.
김예나 기자 yena@hankyung.com

