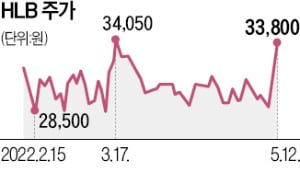
 에이치엘비는 간암 환자를 대상으로 한 리보세라닙과 캄렐리주맙 병용 임상 3상에서 1차 유효성 지표를 충족했다고 12일 밝혔다. 1차 유효성 지표는 신약 후보물질의 효능을 가늠하는 가장 중요한 잣대다. 에이치엘비는 리보세라닙과 캄렐리주맙을 투여받은 간암 환자의 전체 생존기간(OS)과 병이 악화하지 않고 지내는 기간(PFS)이 기존 약을 투여받았을 때보다 개선됐다고 했다.
에이치엘비는 간암 환자를 대상으로 한 리보세라닙과 캄렐리주맙 병용 임상 3상에서 1차 유효성 지표를 충족했다고 12일 밝혔다. 1차 유효성 지표는 신약 후보물질의 효능을 가늠하는 가장 중요한 잣대다. 에이치엘비는 리보세라닙과 캄렐리주맙을 투여받은 간암 환자의 전체 생존기간(OS)과 병이 악화하지 않고 지내는 기간(PFS)이 기존 약을 투여받았을 때보다 개선됐다고 했다.에이치엘비는 데이터 추가 분석을 거쳐 향후 개최될 글로벌 암 학회에서 결과를 공식 발표할 예정이다. 회사 관계자는 “핵심적인 지표가 통계적으로 유의미하다는 점을 확인했다”고 했다.
리보세라닙은 에이치엘비가 2009년 미국 바이오회사에 지분 투자하면서 기술을 도입한 후보물질이다. 현재 글로벌 판권을 갖고 있다.
에이치엘비는 내년 1분기 내에 FDA에 품목 허가를 신청할 예정이다. 미국, 중국, 한국 등 세계 13개 국가에서 543명을 대상으로 한 글로벌 임상인 만큼 품목 허가에 대한 기대가 크다.
에이치엘비는 간암 외에 말기 위암과 선양낭성암을 대상으로도 임상을 완료했다. 말기 위암과 선양낭성암 두 암종에 대해서는 병용 임상이 아니라 리보세라닙을 단독으로 투여하는 임상이다. 말기 위암 대상 임상 3상은 2019년 끝냈지만 1차 지표를 충족하지 못했다. 에이치엘비는 이후 FDA의 요청에 따라 3년째 임상 데이터를 보완하고 있다. 선양낭성암은 임상 2상을 최근 마무리했다. 다음달 열리는 미국 임상종양학회(ASCO)에서 결과를 발표할 계획이다.
에이치엘비 관계자는 “선양낭성암은 아직까지도 마땅한 치료제가 없어 임상 2상 결과만으로 품목 허가를 신청할 수 있을 것으로 기대한다”며 “내년 1분기까지 최소 2개 암종에 대해 품목 허가를 신청하겠다”고 했다.
한재영 기자 jyhan@hankyung.com

