한올바이오파마는 안구건조증 치료제 ‘HL036’, 자가면역치료제 HL161 등의 후보물질(파이프라인)을 보유하고 있다. HL036은 중국 하버바이오메드, HL161은 하버바이오메드와 미국 로이반트에 각각 기술수출했다.
지난달 아젠엑스(ArgenX)의 ‘비브가르트’(성분명 에프가티지모드)가 FcRn 저해제로는 처음으로 미국 식품의약국(FDA)의 승인을 받았다. '면역글로불린G(IgG)'의 수용체인 FcRN을 차단하는 신약이다. 이번에 승인을 받은 적응증은 전신중증근무력증(gMC)이다. 근력이 약화되는 만성 신경근 질환이다.
오승택 연구원은 “FcRn 1호 신약 탄생으로 한올바이오파마를 비롯한 후발주자들도 3상 이후 상업화 속도가 가속화될 것”이라고 전망했다.
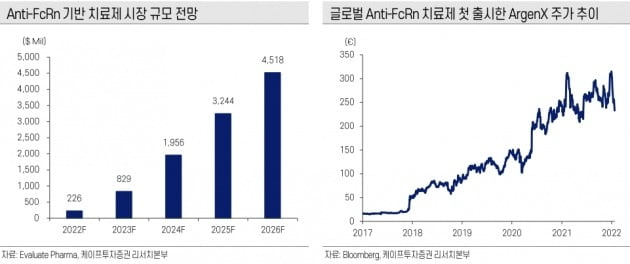
한올바이오파마도 FcRn 저해제인 HL161을 보유하고 있다. 앞서 진행한 전신중증근무력증 환자 대상 임상 2상에서 일상생활수행능력(MG-ADL) 기준 우수한 효능을 보였다. 면역글로불린 감소 수치 또한 개선세를 나타냈다.
HL161은 제형에서의 강점도 있다는 평가다. 피하주사(SC) 제형으로 개발돼 정맥주사(IV) 투여 방식의 비브가르트 대비 편리하다는 것이다.
오 연구원은 “HL161은 전신중증근무력증과 용혈성빈혈(WAIHA) 적응증으로는 제형 편의성을 높여 계열 내 최고신약(Best-in-class)를 노리고, 다른 FcRn 저해제가 대상으로 하지 않는 갑상선안병증(TED)로는 혁신신약(First-in-class)을 준비 중”이라고 했다. 갑상선안병증은 안구 근육 섬유화 및 지방 축적으로 안구가 돌출되는 병이다.
저밀도지방단백질(LDL) 콜레스테롤 수치 부작용은 통제 가능할 것이란 판단이다. 로이반트의 HL161 개발 전담 자회사인 이뮤노반트는 작년 2월, 갑상선안병증 임상 2b상에서 LDL 콜레스테롤 수치 부작용 문제로 임상을 중단했다 6월 재개를 선언했다.
당시 이뮤노반트 측은 “환자 관찰과 투약 방법 및 주기 변경, 필요 시 스타틴(statin) 계열 약물의 처방 등을 통해 LDL 수치를 관리할 수 있다”고 재개 이유를 설명했다.
오 연구원은 “해당 환자들의 수치가 투약 종료 후 8주 뒤 다시 정상으로 회복됐고, 기저 LDL 수치가 높은 환자 대상으로도 스테틴 병용 투여 등으로 제어가 가능하기 때문에 신약 파이프라인 가치 훼손은 제한적일 것”이라고 했다.
이도희 기자



