5일 업계에 따르면 최근 길리어드와 갈라파고스가 공동 개발하고 있는 ‘자이셀레카’(성분명 필고티닙)에 대한 미국 식품의약국(FDA) 신약허가신청(NDA) 승인이 불발됐다.
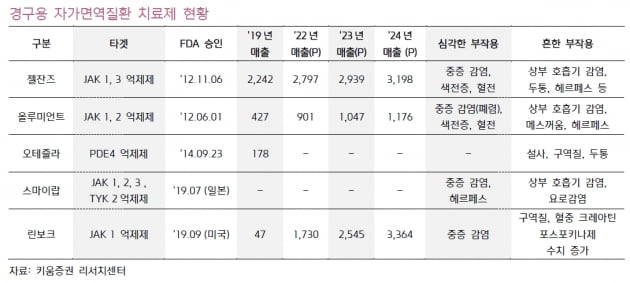
길리어드는 중등도에서 중증에 이르는 활동성 류머티즘 관절염(RA) 치료제로 자이셀레카를 개발하고 있다. 자이셀레카는 필고티닙 200mg 및 100mg의 알약이다. 1일 1회 경구용 선택적 '야누스 인산화효소 1(JAK1)' 저해제의 일종이다.
고용량의 필고티닙 투여 시 독성이 문제가 됐다. FDA는 필고티닙 200mg 투여량의 전반적인 위해성 대비 유익성에 대해 우려를 표명한 것으로 알려졌다.
최초의 경구용 류머티즘 관절염 치료제인 화이자의 ‘젤잔즈’(JAK 억제제)도 10mg에서 혈전증의 부작용이 발견됐다.
이에 따라 JAK 억제가 아닌 다른 방식(기전)의 경구용 자가면역질환 치료제에 대한 관심이 커질 것으로 예상되고 있다.
젤잔즈 및 일라이릴리의 올루미언트 등은 류머티즘 관절염 발병에 관여하는 염증성 사이토카인 세포 안의 신호전달 경로인 JAK를 억제한다.
국내에서는 오스코텍과 종근당이 경구용 자가면역질환 치료제를 개발하고 있다.
종근당의 ‘CKD-506’은 유럽 5개국에서 류머티즘 관절염 환자를 대상으로 임상 2a상을 진행 중이다. 올 4분기 주요 결과(톱라인)를 공개할 예정이다.
CKD-506은 세포독성 T림프구 항원(CTLA-4)과 종양괴사인자(TNF-α)를 조절하는 이중기전으로 차별성을 지니고 있다. 염증 악화를 촉진하는 단백질 및 염증 세포의 활성화를 억제하면서 면역T세포 기능을 강화한다.
이혜린 KTB증권 연구원은 “다음달 CKD-506에 대한 성공적인 임상 결과가 공개되면 적응증 확장성과 편의성 등의 측면에서 가치가 더해질 것”이라며 “기존에 부작용이 심한 JAK 저해제 경구 치료제와 고가의 바이오의약품을 대체할 수 있을 것”이라고 말했다.
오스코텍의 ‘SKI-O-703’은 ‘SYK’ 저해제다. 세포 안의 SYK를 억제해 면역세포의 비정상적 활성화를 차단한다. JAK 억제제들과 달리 주로 B세포를 표적해 작용한다. 동물실험에서 효능 및 부작용에서 젤잔즈보다 우위를 나타냈다.
SYK 저해제 중에서는 아직까지 류머티즘 관절염으로 허가받은 의약품이 없다. SKI-O-703이 류머티즘 관절염 치료제로 승인되면 혁신신약(First-in-Class)의 지위를 얻게 된다.
허혜민 키움증권 연구원은 “현재 진행 중인 SYK억제제 2a상에서 안전성과 효능이 입증되면 용량을 높이지 못하는 JAK 억제제와의 병용 수요가 커질 것”이라며 “두 물질 모두 경구용이기 때문에 복용 편의성과 높은 효능을 기대할 수 있어 기술이전 가능성도 높아질 것"이라고 했다.
김예나 기자 yena@hankyung.com


