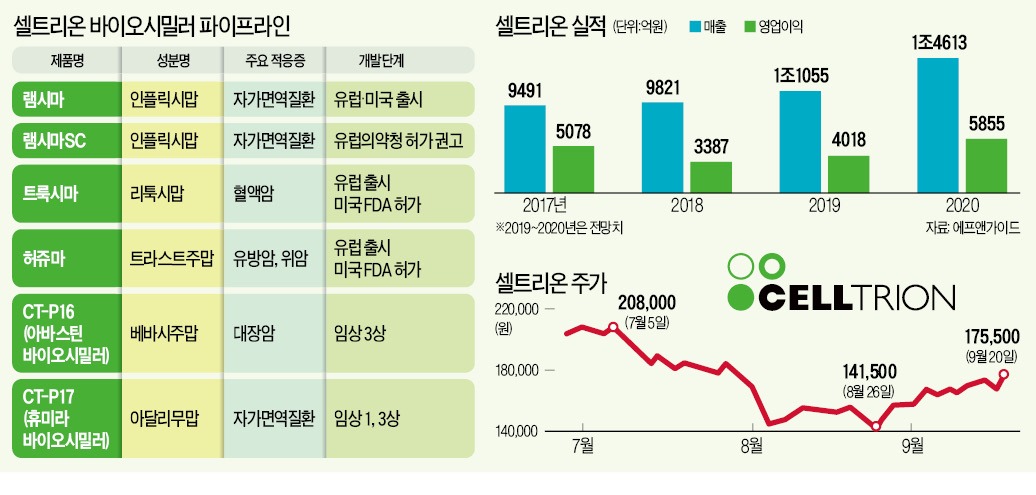
램시마는 존슨앤드존슨이 개발한 레미케이드의 바이오시밀러다. 램시마SC는 램시마를 피하주사형으로 만든 세계 최초의 인플릭시맙 제제다.
램시마, 레미케이드, 플릭사비 등 인플릭시맙 제제는 자가면역질환에 효과가 좋아 연간 43조원의 시장을 형성하고 있다. 하지만 인플릭시맙 제제를 투여하려면 병의원을 찾아 정맥에 주사하는 것 외에는 방법이 없다. 이 때문에 발병 초기 인플릭시맙 제제로 투여를 한 뒤 자가주사가 가능한 휴미라나 엔브렐 등 다른 성분의 제품을 이용하는 경우가 일반적이다. 환자들로서는 치료제 외에 정맥주사 투여 비용까지 이중 부담을 지는 셈이다. 셀트리온은 2015년 램시마SC 개발에 들어가 지난해 11월 EMA에 허가를 신청했다.
셀트리온은 램시마SC가 자가면역질환 시장의 ‘게임 체인저’가 될 것으로 기대하고 있다. 인플릭시맙 제제를 투여하던 환자들은 물론 휴미라나 엔브렐을 쓰던 환자까지 램시마SC로 끌어들일 수 있다는 판단에서다. 휴미라의 지난해 매출은 199억달러(약 23조5600억원)로 세계 1위 의약품에 이름을 올렸다.
서정진 셀트리온그룹 회장은 지난달 말 열린 ‘2019 대한민국 바이오 투자 콘퍼런스’에서 “램시마SC는 유럽 의사들이 언제 허가가 나는지 물어보는 제품”이라며 “램시마SC가 허가를 받는다면 셀트리온그룹 비전 2030의 투자 자금이 될 것”이라고 말했다. 셀트리온은 2030년까지 바이오의약품 사업 25조원, 합성의약품 사업 5조원, U-헬스케어 사업 10조원 등 총 40조원 규모의 투자계획을 세워놓고 있다.
셀트리온은 램시마SC가 허가를 받는 동시에 직판 체계를 가동한다는 방침이다. 해외에 의약품을 판매하려면 현지 제약사 및 유통사에 제품 가격의 35~40%를 수수료로 지급해야 한다. 직판 체계를 구축하면 판매 비용이 제품가의 10~15% 선으로 떨어진다. 셀트리온헬스케어는 유럽 5대 시장인 영국, 독일, 프랑스, 이탈리아, 스페인에 법인·지점 설립을 마쳤다. 기존 법인까지 합치면 유럽에서 운영 중인 법인은 15개에 달한다. 셀트리온은 램시마SC 출시에 발맞춰 유럽 판매망 구축에 박차를 가할 계획이다.
셀트리온은 오는 26~27일 서울과 부산에서 소액주주들을 대상으로 한 기업설명회를 연다. 지난해 9월 최고 30만6000원까지 상승했던 셀트리온 주가는 지난달 26일 52주 최저가인 14만1500원까지 떨어졌다. 이달 들어선 반등세를 나타내면서 17만원 선을 회복했다. 이날 유가증권시장에선 7000원(4.15%) 오른 17만5500원에 거래를 마쳤다.
셀트리온 관계자는 “기관투자가들에 비해 상대적으로 회사정보를 직접 접할 기회가 적었던 소액주주들에게 최근 경영 상황과 연구개발 진행 상황을 설명할 것”이라고 말했다.
박상익/이태호 기자 dirn@hankyung.com

